概要
理化学研究所(理研)環境資源科学研究センター細胞機能研究チームの陳渝大学院生リサーチ・アソシエイト(東京大学大学院理学系研究科博士課程(いずれも研究当時)、現細胞機能研究チーム特別研究員)、杉本慶子チームリーダー(東京大学大学院理学系研究科教授(兼任))、中部大学応用生物学部の鈴木孝征教授らの共同研究チームは、光が新しい分裂組織※1の再生を制御する分子メカニズムを解明しました。
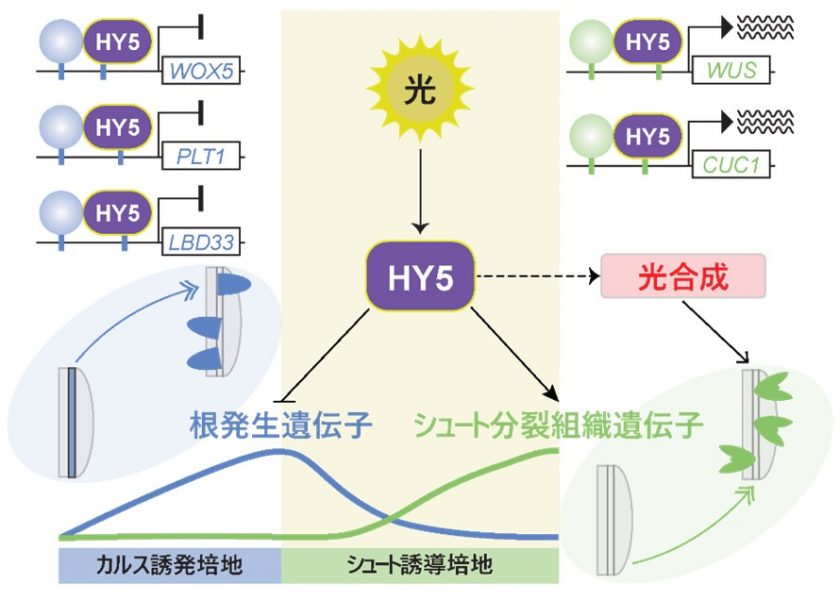
本研究成果は、植物幹細胞※2制御の理解の深化や組織培養技術の効率向上など、持続的な食料供給やバイオマス生産に貢献すると期待されます。今回、共同研究チームは、光シグナルが多能性カルス※3からの根形成を抑制し、シュート(茎とそれに付いている葉)の再生を促進することを発見しました。光シグナルの伝達に重要な転写因子※4であるELONGATED HYPOCOTYL 5(HY5)は、新しい分裂組織の運命を制御する中心的な役割を果たしていることを明らかにしました。さらに、光合成※5の初期活性化がシュート発生に重要であり、これはHY5依存経路の下流で転写制御されていることが分かりました。
本研究は、科学雑誌『Plant Physiology』オンライン版(9月24日付)に掲載されました。
背景
植物は顕著な発生可塑性※6を持っており、傷害を受けると新しい組織や器官を再生することができます。環境条件は植物の成長や発達に大きな影響を与えることはよく知られていますが、これらの環境シグナルが植物の再生にどのような影響を与えるのかは、まだ十分に解明されていませんでした。
杉本チームリーダーらは、これまでに植物の成長や再生を制御する分子機構について研究を進め、植物成長の環境応答のメカニズム注1、2)や、植物再生のリプログラミングのメカニズム注3~5)を解明するなど、重要な成果を発表してきました。
今回、共同研究チームは最も重要な環境条件である光に注目し、それが植物再生における分裂組織の新しい運命決定にどのように関与しているかを研究しました。
注1)2020年3月20日プレスリリース「葉の伸長成長の制御機構を解明」
注2)2022年6月18日プレスリリース「栄養が豊富過ぎると根毛は伸びなくなる」
注3)2019年11月4日プレスリリース「植物細胞のリプログラミングの仕組みを分子レベルで解明」
注4)2021年8月20日プレスリリース「植物の再生と防御のスイッチ」
注5)2022年8月4日プレスリリース「分化細胞からの植物体再生」
研究手法と成果
共同研究チームはまず、シロイヌナズナ※7の胚軸再生における光シグナルの影響を、2段階の組織培養系※8を用いて調べました。その結果、胚軸の切断後に光強度を増加させるとシュートの再生が著しく促進され、光シグナルが新しいシュート分裂組織の運命を獲得するために必要であることが分かりました(図1中)。続いて、光シグナルによって活性化されるマスターレギュレーター※9であるHY5に注目し、新しい器官形成におけるその機能を詳しく調査しました。HY5の機能喪失変異体※10を用いた実験から、HY5が根の形成を抑制し、シュートの再生を促進する役割を担っていることが示唆されました(図1右)。
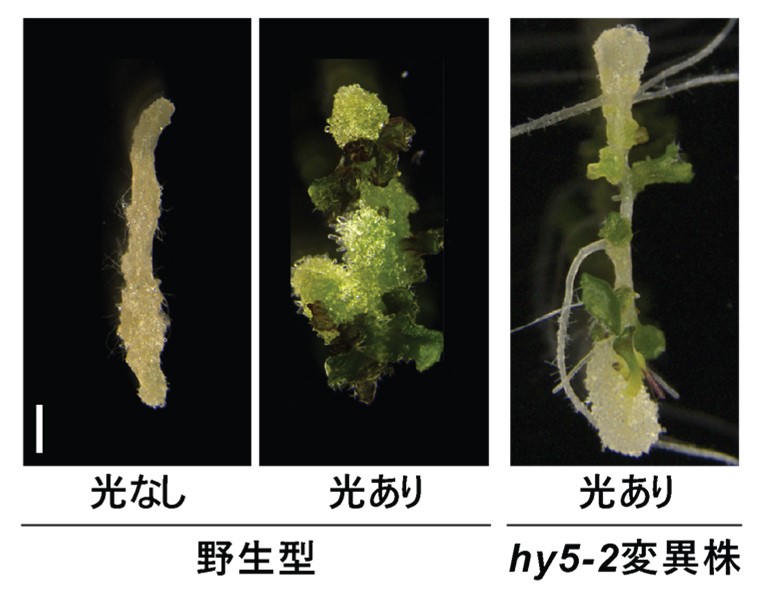
通常、切断された胚軸から再生された組織はシュート分裂組織の運命を獲得し、シュートを再生する(中図)。光なしの条件やhy5-2変異株ではシュート分裂組織の運命が獲得されないため、シュートの再生が抑制される(左、右図)。スケールバーは1mm。
次に、HY5が介在する光シグナルがどのように器官再生を制御するか、その分子メカニズムを解明するために、野生型およびhy5-2変異株を用い、低照度および高照度光条件下でRNA次世代シーケンス解析(RNA-Seq)※11を行いました。発現レベルに有意差が見られる遺伝子を解析した結果、光シグナルとHY5によって制御される遺伝子群を同定しました。これらの解析から、HY5が、WUSCHEL RELATED HOMEOBOX 5(WOX5)、PLETHORA 1(PLT1)やLATERAL ORGAN BOUNDARIES DOMAIN 33(LBD33)など、根発生に関与する遺伝子の発現を抑制し、逆にWUSCHEL(WUS)やCUP-SHAPED COTYLEDON 1(CUC1)など、シュート分裂組織に関与する遺伝子の発現を誘導することが示されました(図2)。
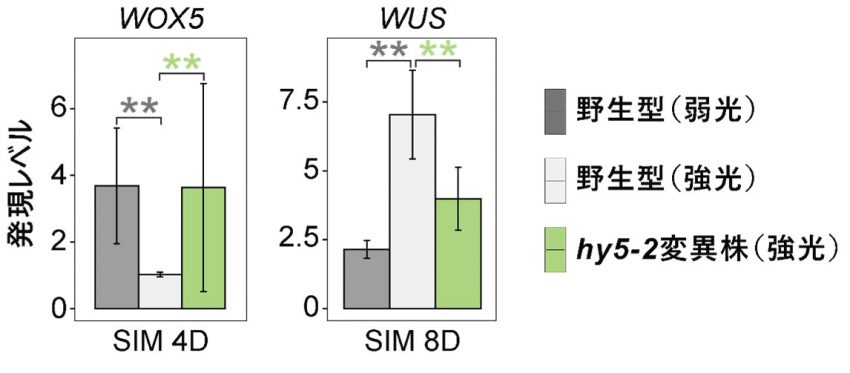
HY5を介して光シグナルは根発生に関与する遺伝子(WOX5)の発現を抑制し(左図)、シュート分裂組織に関与する遺伝子(WUS)の発現を誘導する(右図)。SIM 4D/8Dはシュート誘導培地上で培養した4日後/8日後を示す。アスタリスク(*)は統計的に有意な差を示す。
さらに、HY5が根発生やシュート分裂組織に関与する遺伝子に直接作用するかどうかを検証するために、電気泳動移動度シフトアッセイ(EMSA)※12およびクロマチン免疫沈降―リアルタイムポリメラーゼ連鎖反応(ChIP-qPCR)※13を実施しました。その結果、HY5がこれらの遺伝子プロモーター領域※14内の光応答性シス調節エレメント※15に直接結合することを見いだしました。また、顕微鏡解析、生化学的および遺伝学的解析の結果、HY5が新しい分裂組織の運命を決定する際に、転写抑制と転写促進の二重機能を持つことが確認されました。
最後に、HY5を介した光シグナルが光合成に関する遺伝子の発現を強く誘導し、培養初期段階から光合成を活性化させることも確認されたため、光合成の活性化がシュートの再生に必要であるという仮説を立てました。この仮説を検証するために、光合成阻害剤DCMU※16で処理した胚軸再生の表現型を評価しました。この実験から、HY5に依存した光合成の活性化がシュートの再生に重要な役割を果たしていることも明らかになりました。
今後の期待
本研究により、植物再生中の新しい分裂組織の運命確立を光が制御する複雑なメカニズムを明らかにしました。また、HY5転写制御ネットワークがこのプロセスにおいて中心的な役割を果たしていることを示し、植物の発生可塑性に対する光シグナルの影響を浮き彫りにしました。
今後は、シングルセルRNAシーケンス解析※17を用いて、光シグナルによって器官再生運命が決定される細胞群を特定します。1細胞レベルでの遺伝子発現情報から、幹細胞がリプログラミングされる際の細胞クラスターや新規の再生因子を明らかにすることを目指しています。これらにより、植物発生過程における幹細胞制御の理解を深めるとともに、植物再生の効率を向上させる実用的な手法を提供し、農業や園芸分野で応用されることが期待されます。
本研究成果は、国際連合が定めた17項目の「持続可能な開発目標(SDGs)※18」のうち、「2.飢餓をゼロに」と「15.陸の豊かさも守ろう」に大きく貢献するものです。
論文情報
<タイトル>ELONGATED HYPOCOTYL5-mediated light signaling promotes shoot regeneration in Arabidopsis thaliana
<著者名>Yu Chen, Yetkin Çaka Ince, Ayako Kawamura, David S. Favero, Takamasa Suzuki, Keiko Sugimoto
<雑誌>Plant Physiology
<DOI>10.1093/plphys/kiae474
補足説明
※1 分裂組織
植物の成長を担う、未分化な細胞が集まっている部位で、細胞分裂を繰り返し、新しい組織や器官を作り出す。
※2 植物幹細胞
植物の成長点や分裂組織に存在する細胞で、自己複製能力と多様な細胞に分化する能力を持つ。
※3 多能性カルス
植物の再生過程で形成される未分化の細胞塊で、さまざまな器官になることができる潜在的な能力を持つ。
※4 転写因子
DNA上の特定の配列を認識し、そこに直接結合することで、遺伝子の転写を促進または抑制するタンパク質。
※5 光合成
光のエネルギーを利用して無機炭素から有機化合物を合成する生化学的プロセス。
※6 発生可塑性
生物が異なる環境条件や内的な要因に応じて、発生過程や形態的特徴を変化させる能力。
※7 シロイヌナズナ
アブラナ科に属する小型の一年生植物。持っている遺伝子の総量が比較的少なく、発芽してから開花し種子が採れるまでの時間が比較的短いことから、広く植物学の研究に用いられるモデル生物(普遍的な生命現象の解明に用いられる代表的な生物)の一つになっている。2000年に、植物として初めて全ゲノムが解読された。
※8 2段階の組織培養系
植物の組織や細胞を培養する際に、二つの異なる培養ステージを経て組織や器官を再生する方法。1段階目の培養で多能性の獲得が促進され、2段階目の培養で形成された分裂組織が新しく運命決定されることによって、根またはシュート器官再生が起きる。
※9 マスターレギュレーター
下流にある多数の遺伝子の発現を一括して制御する転写因子。
※10 機能喪失変異体
遺伝子の変異により、特定の遺伝子の機能が損なわれた変異体。
※11 RNA次世代シーケンス解析(RNA-Seq)
生物の細胞や組織から抽出したRNAの全転写産物(トランスクリプトーム)を、相補的なDNAに変換したものの配列を、次世代シーケンサーを用いて解読し、遺伝子の発現レベルや転写産物の構造を解析する方法。
※12 電気泳動移動度シフトアッセイ(EMSA)
DNAやRNAと結合するタンパク質(通常は転写因子)との相互作用を評価するために、ゲル電気泳動を用いて、結合複合体の移動度の変化を測定する方法。
※13 クロマチン免疫沈降―リアルタイムポリメラーゼ連鎖反応(ChIP-qPCR)
特定のタンパク質がクロマチン(染色体)上の特定のDNA領域に結合しているかどうかを調べるための方法で、クロマチン免疫沈降(ChIP)によって特定のDNA-タンパク質複合体を分離し、リアルタイムポリメラーゼ連鎖反応(qPCR)でそのDNAの量を定量的に測定する技術。
※14 プロモーター領域
遺伝子をコードするDNA領域の上流に存在し、RNAポリメラーゼや転写因子が結合して転写を開始するためのDNAの特定の配列領域。
※15 シス調節エレメント
遺伝子の転写開始点近くのDNA配列で、転写因子やその他の調節因子が結合して、遺伝子の発現を調節するエレメント。
※16 DCMU
3-(2,4-ジクロロフェニル)-1,1-ジメチル尿素の略で、典型的な光合成阻害型除草剤である。
※17 シングルセルRNAシーケンス解析
個々の細胞にそれぞれ異なるバーコードを付与することで、得られるRNAをシーケンシングし、細胞ごとの遺伝子発現プロファイルを詳細に解析する技術。
※18 持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17のゴールから構成され、地球上の誰ひとりとして取り残さないことを誓っている。SDGsは発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる。
共同研究チーム
理化学研究所 環境資源科学研究センター 細胞機能研究チーム
大学院生リサーチ・アソシエイト(研究当時)
陳 渝 (チン・ユウ)
(東京大学 大学院理学系研究科 博士課程 (研究当時)
現 細胞機能研究チーム 特別研究員)
基礎科学特別研究員 インジェ・エトキン・チャカ(Yetkin Çaka Ince)
テクニカルスタッフⅡ 河村彩子(カワムラ・アヤコ)
訪問研究員(研究当時) デービッド・ファベロ(David S. Favero) (日本学術振興会特別研究員(研究当時))
チームリーダー 杉本慶子(スギモト・ケイコ)
(東京大学 大学院理学系研究科 教授(兼任))
中部大学 応用生物学部
教授 鈴木孝征(スズキ・タカマサ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業基盤研究(B)「植物の器官再生を制御する分子機構(研究代表者:杉本慶子)」、同学術変革領域研究(A)「不均一環境変動に対する植物のレジリエンスを支える多層的情報統御の分子機構」の研究課題「植物の環境レジリエンスを支える傷害修復機構(研究代表者:杉本慶子)」、科学技術振興機構(JST)先端国際共同研究推進事業「植物の誘導リプログラミングに立脚した新規バイオエコノミー基盤の創出(研究代表者:杉本慶子)」、同革新的GX技術創出事業(GteX)「先端的植物バイオものづくり基盤の構築(研究代表者:大熊盛也)」、理化学研究所(RIKEN)若手研究者の登用・育成制度 大学院生リサーチ・アソシエイト(JRA)(採用対象者:陳渝)(研究当時)、同基礎科学特別研究員(SPDR)(採用対象者:インジェ エトキン チャカ)による支援を受けて行われました。
発表者
理化学研究所 環境資源科学研究センター 細胞機能研究チーム
大学院生リサーチ・アソシエイト(研究当時)
陳 渝(チン・ユウ)
(東京大学 大学院理学系研究科 博士課程(研究当時)、
現 細胞機能研究チーム 特別研究員)
チームリーダー 杉本慶子(スギモト・ケイコ)
(東京大学 大学院理学系研究科 教授(兼任))
中部大学 応用生物学部教授 鈴木孝征(スズキ・タカマサ)

本学の問い合わせ先
研究に関すること
鈴木 孝征(中部大学 応用生物学部 応用生物化学科 教授)
E-mail:sem6875[at]fsc.chubu.ac.jp ※アドレスの[at]は@に変更してください。
報道に関すること
中部大学 学園広報部広報課
Eメール:cuinfo[at]office.chubu.ac.jp ※アドレスの[at]は@に変更してください。
電話:0568-51-7638(直通)

